Dabas minerāli akvārija gruntij (1.daļa)
Jautājumi par gruntīm regulāri rodas visos akvāriju
forumos un lapās. Diemžēl, mūsdienu akvāriju un poludāriju literatūrā
šīs problēma tiek skatīta virspusēji vai viss tiek skaidrots vispārēji, ka neko
īsti saprast neizdodas (Iļjins, 1968; Cirlings, 1991; Malhins, 1998, Kasseļmans
2001; Gusjevs, 2002 un citi). Vēlos uzreiz piebilst, ka neapskatīšu grunts
graudu izmērus vai krāsas, vai sintētisko materiālu izmantošanu, kas jau
pieteikami izskatītu interneta resursos, piemēram, Slavas Judakova rakstā
“Akvārija gruntis” (Слава Юдаков "Грунт в
аквариуме"), materiālu izvēli tāpat var
izpētīt mājas lapā палюдариум.ру.
Lai arī viss šķiet vienkārši, akvāriju
grunts tomēr ir sarežģīta, daudz komponentu sistēma. Tajā var izdalīt kā
minimums 2 galvenās sastāvdaļas: minerālo (uzbūve) un organiski minerālo.
Zem minerālās daļas jāsaprot smiltis,
oļus, granti, lielie akmeņi, tas ir, daudzveidīgi kalnu minerāli, mākslīgie
materiāli (stikls, keramzīts, plastitks un citi). Tos izmanto kā substrātu, lai
stādītu un noturētu augus, radot dekoratīvu noformējumu un veidojot grunts
pamatsastāvu.
Organisko minerālu daļa – tie ir mālveida
minerāli, laterīts, dažādi organiskie savienojumu, akvārija organismu blakus
produkti, augu augšanu pastiprinošās piedevas un citas vielas, kuras piedalās
augu barības ciklā.
Minerālo grunts daļu veido kalnu ieži un
minerāli, kuras ar var iedalīt daļās:
- Ķīmiski noturīgie (stabilie);
- Ūdens vidē šķīstošie (nestabili, piem., karbonāti, sulfāti, hlorīdi).
Piebilstot var izdalīt toksiskos vai
bīstamos savienojumus (sēra, ciankālija, dzīvsudraba, antimona un citi
savienojumi), bet ja no akvārija neveido dekoratīvu minerālu izstādi, tad
varbutība akvārijā nokļūt šādiem savienojumiem ir tik pat kā neiespējama.
Organiski minerālo daļu var sadalīt
mālainā (minerālā), organisko un bakteriālo daļu.
Līdzīgas idejas regulāri var atrast
dažādos darbos, bet manuprāt, joprojām nav līdz galam noformulētas. Piemēram,
ja akvārijā radušās kādas problēmas, tad pilnībā vai deļējo iztīrot akvāriju,
nekad neatbrīvosimies no grunts, pietiks to kartīgi izskalot, izvācot organiski
minerālo daļu un minerālā daļa atkal būs izmantojama.
Stabilie minerāli un kalnu ieži

Granīts. Pelēkais granīts

Bazalts. Dažādi bazalta veidi (Kamčatka),
paraugu izmērs 10-12cm

Kvarcs. Kvarca paveids – morions un kalnu
kristāls

Laukšpats. Viens no tā paveidiem amazonīts
vai amazones akmens.
Ūdenī šķistoši minerāli un kalnu ieži.

Halīts un silvīns. Akmens sāls no
Sahalīnas apgabala. Pelēkie un krāsu slāņi – halīts NaCl; sarkani brūnie –
silvīns KCl.

Anhidrīts. Paraugs ar sķīduma pazīmēm no
Kamskas ūdenkrātuves krastime. Parauga izmērs 20cm.

Ģipsis. Augšpusē ģipša kristāli, pa kreisi
ģipša “ledene”- caurspīdīgs kristāls ar kusuma pazīmēm ūdenī. Liels caurspīdīgs
ģipša kristāls ar kristāliska sēra iekļāvumiem

Kalcīts. Kalcīta drūzai brūno krāsu piešķir
liels daudzums zelsz hidroksīda iekļāvumu.

Kalcīts. Kalcīta drūzas ar kristāliem
dažādā formā un krāsā. Paraugu izmērs 12-15cm.

Aragonīts. No kalcīta atšķiras ar sešstūra
(adatveida) kristālu formu un lielāku šķīdamību ūdenī, kas saistīta ar minerālu
kristālu struktūru.
Toksiskie minerāli

Antimonīts. Antimonīta kistāli Sb2S3
. Atklātā veidā viegli veido oksīdus un antimona hidropaskābes.

Sērs (ieslēgumi kalcītā). Sēra kristāli ir
gaiši zaļā, tumši brūnā (selēna piejaukums), spilgti sarkanā (arsēna
piejaukums) krāsā. Viegli noteikt peč krāsas, drupenuma un degšanas. Atklātā
veidā sērs oksidējas, veidojot sērskābi, dažreiz baktēriju ietekmē partop
sērūdeņradī.
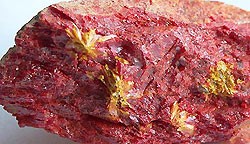
Realgārs ar auripigmenta iekļāvumiem.
Spilgti sarkanie, oranži sarkanie realgāra kristāli As4S4
gaismas ietekmē viegli sadalās un oksidējas. Auripigments As2S3
– citrondzelteni kristāli viegli sadalās veidojot arsēna oksīdus. Pat neliela
deva šo savienojumu radīs ūdens organismu saindēšanos.

Kinovārs. HgS – dzīvsudraba sulfīda
kristāli ir no spilgti sarkana līdz kiršu sarkanai krāsai. Viens no stabilākiem
sulfīdiem, ko bieži pavada dzīvsudrabs, dzīvsudraba oksīdi un halogēni.
Ūdens, baktēriju un humīnskābju ietekmē,
daļa kristālu un kalnu iežu sairst – fiziski, ķīmiski un bioloģiski izdaloties
vai savienojoties. Sadalīšanās intensitāte (ātrums) atkarīgs no daudziem
parametriem, bet tā ir salīdzinoši lēna, lai spētu nodrošināt atri augošus
augus ar barības vielām. Ja minerālā daļa nav augu barības vielu avots, tad to
mainīt nepieciešams tikai tad, kad tā apnīk akvārija īpašniekam. Pretēji ir ar
organiski minerālo daļu – tās ir salīdzinoši maz pēc apjoma, bet tajā intensīvi
norisinās dažādi ķīmiskie un bioķīmiskie procesi. Organisko vielu sadalīšanās
un dažādu baktēriju darbība veido dažādus kīmiskos savienojumus, kurus pēc tam
viegli absorbā augi. Tiesi uz šo grunts daļu arī ir vērsti vairums akvāriju
turētāju pūliņi audzējot augus un arī lielas kompānijas pie tā strādā,
piemēram, Tetra, Sera, Aquarium pharmaceuticals un citas. Var pieminēt māla
lodītes, kūdru, dārza zemi, dažādas grunts tabletes, granulas un barojošus
maisījumus (piemēram, CompleteSubstrate, Crypto, ZMF Dynoplant, InitialSticks
un citas) un ja tajos ir kāds minerāls substrāts, tad tikai tilpuma palielināšanai.
Tāpat loģiskākā darbība barības vielu trūkuma gadījumā būs palielināt vai izmainīt
organiski minerālo grunts daļu. Saprātigiem akvāriju turētājiem nerodas vēlme,
barības vielu trūkuma gadījumā, augiem piebērt vēl klāt smiltis vai oļus,
kuriem šķistot izdalītos papildus barības vielas, vismaz es tā ceru.

Dažādas grunts piedevas, lai palielinātu
augu augšanu un veidošanos
Lai saprastu, kas notiek ar kalnu iežiem
un minerāliem akvārija vidē, jāiepazīstas ar procesiem, kas norisinās dabīgā
vidē, jo īpaši ar ķīmiskās sadalīsānās procesu.
Kalnu iežu un minerālu ķīmiskās sadalīšanās veidi un ātrums
Vairums magmātisko, metamorfozisko un
nosēdumu iežu (ar nelieliem izņēmumiem) ir salīdzinoši stabili un ja arī
noārdās, tad ļoti lēni. Jāsaprot, ka vienkāršie ķīmiskie vienādojumi ilustrē
tikai iespējamo ķīmisko reakciju, bet nakādi nenorāda šīs reakcijas ātrumu
(Ollier, 1984).
Ķīmiskās noārdīšanās būtība ir ķīmiska
mijiedarbība starp minerāliem, ūdeni un gaisu, mainot minerāla ķīmisko sastāvu
zemes virsmas apstākļos, veidojot jaunus stabilus minerālus.
Ķīmiskie savienojumu, kas iekļauti kalnu
iežos, pēc šķīdības pakāpes un kustības iedalās 4 grupās. No iežiem pirmie
izdalās hlora un sēra savienojumi (hlorīdi, sulfāti). Tad – kalcija savienojumi
ar nātriju, magnijs un kālijs (karbonāti). Vēl lēnāk šķīst silīcija oksīds, kas
ir silikātu sastāvā un pēdējie sadalās dzelzs un alumīnija oksīdi un brīvie
silīcija oksīdi.
Ķīmiskās sadalīšanās procesā vērjamas
šādas reakcijas: šķīdamība, oksidēšanās, atjaunošanās, hidrolīze,
karbonizācija, hidratizācija un halatizācija (Polinovs, 1934; Strahovs, 1960;
Lukaševs, 1963, Ollier, 1984). Dabā dažādos ķīmiskos un fiziskos procesos
piedalās dzīvi oraganismi, kas būtiski ietekmē sairšanas procesa būtību un
ātrumu.
Jo vairāk mainīgo sistēmā, jo grūtāk
paredzēt reakcijas gaitu un sairsānas procesos parasti mainīgo skaits ir ļoti
liels. Piemēram, parastā kalcīta šķīšanas reakcijā piedalās 7 mainīgie pat pie
stabilas temperatūras un spiediena. Vēl vairāk, pat vienkārša reakcija var sadalīties
vairākās atšķirīgās stadijās. Kalcīta šķišanas procesā ir 4 atsevišķas
stadijas, vēl lielāks stadiju skaits ir mainoties sarežģītiem māla silikāta
minerāliem (Ollier, 1984).
Pēc P.Veila (Weyl, 1958) datiem kalcīta
šķīšanā izdalās šādas 4 stadijas:
- Kalcija disasociācija uz virsmas starp cieto un šķidro daļu jonos Ca2+ un CO32, tas ir jonu difūzija no virsmas šķīdumā;
- Rekacija starp joniem CO32-, izšķīdušu CO2 un ūdeni veido HCO3-. Patiesībā šī reakcija noteik vairākos posmos;
CO2 + H2O
<=> H2CO3
H2CO3 <=> H+ + HCO3-
CO32- + H+ <=> HCO3-
- Ja šķīdums ir saskarē ar gāzveida fāzi, kurā ir CO2, tad veidojas papildus reakcija
CO2(газ) + H2O
<=> CO2
- Izšķidušo komponemtu difūzija atbilstoši to koncentrācijai.
Daudzu elementu šķīdība atkarība no pH.
Piemēram, dzelzs škīdība pie pH=6 ir aptuveni 100 000 reižu lielāka nekā
pie pH=8,5. pH lielums stipri itekmē alumīnija un silīcija oksīdu šķīdību
(skatīt attēlu). Ja ir zems pH (zem 4), alumīnija oksīds šķīst vairāk nekā
silīcija oksīds. No otras puses starp pH 5-9 alumīnija ksīds praktiski nešķīst,
kamēr silīcija oksīdu šķīdība palielinās.
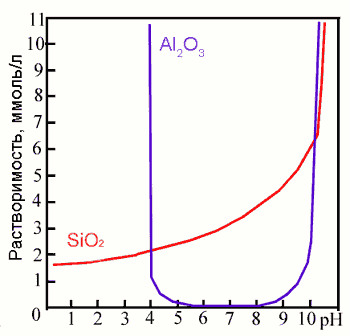
Alumīnija un silīcija oksīdu šķīdamība
atkarībā no pH (Lukaševs, 1963, Mason, 1966)
Pirmā ķīmiskās sadalīšanās stadija parasti
saistās ar šķīdamību tekošā ūdenī vai plānas ūdens plēves ietekmē, kas nosedz
cieto daļu. Šķīdības pakāpe atkarīga no ūdens dadzuma, kas tieši saskaras ar
virsmu. Visvieglāk šķīst ieži un minerāli, kas veidojušies ūdens vidē- hlorīdi,
sulfāti un karbonāti. Hlorīdi: akmens (vārāmā) sāls (NaCl), kālija sāls (KCl)
un citi, tie viegli šķīst ūdenī un izmantot kā grunti neviens neiedomāsies.
Nākamie pēc šķīdības ir sulfāti (ģipsis
CaSO4·2H2O, anhidrīts CaSO4 un citi), paši
grūtāk šķīstošie ir dažādi karbonāti (kalcīts CaCO3, aragonīts CaCO3,
magnezīts MgCO3, dolomīts CaMg[CO3]2, siderīts
FeCO3 un citi.

Ģipša roze. Ģipša kristālu drūza izveidojusies mālainā
stepes augsnē. Izmērs aptuveni 15cm. Skaists akmens, bet akvārijā ātri
sadalīsies, kaut gan kaitējumu neradīs. Ģipša šķīdība ūdenī ir nedaudz lielāka
nekā kalcītam, bet ūdens cietība nemainīsies strauji (radot bīstamību zivīm).


Aragonīts. Argonītu bieži atrod kopā ar kalcītu. Aragonīts
parasti genētiski saistīts ar biogēniem procesiem un no tā veidoti daudzu
molusku gliemežvāki un skeleti, kārtām kārtojoties ar kalcīta slāņiem. Attēlā
redzama amonīta čaula.

Magnezīts

Siderīts. FeCO3. Iespējams šī minerāla klātbūtne
gruntī būs noderīga augiem, jo šķīstot ūdenī tas izdalīs dzelzi. Be zivīm par
daudz dzelzs ūdenī kaitē, jo tas viegli oksidējas veidojot sarkani brūnu
nosēdumu Fe(OH)3, traucējot elpošanu caur žaunām.
Minerālu oksidācija norit caur ūdenī izšķīdušu skābekli.
Oksiedēšanās vislabāk novērojama fiksējot dzelzs oksīdus un hidroksīdus, kas
piešķir daudziem iežiem un minerāliem raksturīgu sarkanu vai dzeltenu krāsu.
Piemēram, siderīta aksidēšanās norit šādi:
4FeCO3 + 6H2O + O2 =>
Fe(OH)3 + 4CO2

Brūna dzelzs rūda. Dabīgs dažādu dzelzs oksīdu un
hidroksīdu maisījums.
Daudzi oksidēšanās procesi norit baktēriju ietkmē, kā
rezultātā baktērijas iegūst enerģiju oksidējot dzelzi, sēru, mangānu un citus
elementus, piemēram, fosforu.
Atjaunošanās ir pretēks process oksidācijai un parasti
norit anaerobā vidē ilgi stāvošā ūdenī. Dzelzs oksīdu atjaunošanās rada
redzamas izmaiņas – sarkanās un dzeltenās krāsas atjaunojoties kļūst zaļas un
pelēkas. Atjaunošanās procesu lielā mērā veic baktērijas, piemēram, sulfāti
pārtop sulfīdos, bet organiskas vielas (humus) atjaunojas fermentējošu
baktēriju ietekmē.
Daudzi silikātie minerāli saturs katjonus, kas viegli maina
oksidēšanās stāvokli, piemēram, Fе2+/Fе3+. Uzkrājot atjaunojošo potenciālu
minerāli, kas satur katjonus, var oksidēties vai atjaunoties. Lai noturētu
elektro neitrālu stāvokli kristāliskā struktūrā jānokļūst vai to jāpamet
papildus joni. Tas noved pie tā, ka kristāliskie režģi klūst nestabili un kļūst
ietekmējami sadalīšanās procesiem, piemēram, hidrolīzei vai pārtapšanai citos
minerālos.
Karbonizācija ir karbonātu vai bikarbonātu jonu reakcija ar
minerāliem. Karbonāti nav sadalīšanās procesa gala produkts, tomēr karbonātu
veidošanās, savā ziņā ir sadalīšanās procesa sastāvdaļa, jo sevišķi sadaloties
laukšpatiem. Ogļskābes ūdens šķīdums (Н2СО3) ir skābe,
kas stipri atvieglo pamatvielu apmaiņas procesu un nepieciešama, lai šķīdinātu
karbonātus.
Hidratācija ir ūdens pievienošana minerālam, piemēram,
dzelzs oksīdi var uztvert ūdeni un pārvērsties hidratētos oksīdos vai dzelzs
hidroksīdos. Hidratācija ir svarīgs process mālveida minerālu izveides procesā,
tā sagatavo minerālu virsmu, lai tālāk noritētu oksidācija vai karbonizācija un
nodrošina vieglāku jonu apmaiņu.
Helatizācija ir veidošanās apkārt kādam kompleksam jonam,
parasti organiskas vielas apļveida uzbūves metālam. Helācijas aģenti var iegūt
jonus no cieām vielām, parasti nešķīstošām un pārvietot jonus tādos apstākļos,
kuros tie parasti parasti izdalās ķīmiskā ceļā.
Hidrolīze ir ķīmiska minerālu un ūdens mijiedarbība, tas
būtu, starp ūdens joniem Н+ un ОН- ar minerāla
joniem.. Šī reakcija noris visur, kur minerāls saskaras ar ūdeni. Hidroližes
reakcija raksturīga silikātiem, alumīnija silikātiem un citiem minerāliem.
Hidrolīzes procesā ОН- joni kopā ar sārmiem un
sārmu izmainītiem metāliem veido vieglus savienojumus, kas pamet iezi.
Mālainie, alumīnija, dzels ksidēti minerāli, kas veidojas hidrolīzes procesā ir
grūti šķīstoši (kaolinīts, hidromika, diaspora, limonīti un citi).
Dzīvie augi un nitrificējošas baktērijas ir pastāvīgs jona
H+ avots, radot skābu vidi un noārda tuvāk esošos minerālus. Augi
apmaina H+ pret barības vielām un zaudējot H+ reakcijām
veidojas disbalans un minerālu sadalīšanās noris visu auga dzīvi, izplatoties
no auga saknes virzienā uz minerāliem.
Tikai pamatojoties uz kopējo grunts un minerālu ķīmisko
sastāvu nevar lemt par sadalīšanās reakciju norisi, jo būtiska loma ir minerālu
kristāliskajai struktūrai. Kalcītiem un aragonītiem ir vienāds sastāvs, tomēr
atomi šajos minerālos izvietoti dažādi kā rezultātā aragonīts ir aptuveni 10x
sķīstošāks nekā kalcīts.
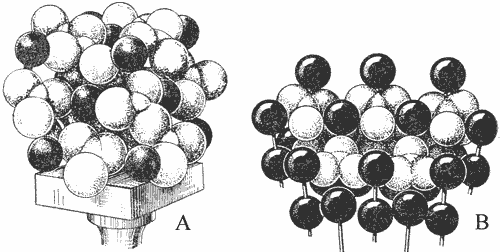
Kalcīta (A) un aragonīta (B) kristālisko režģu modeļi.
Melnās lodītes – kalcija katjoni, gaišie trīsstūri- CO3 anjoni
(Betextins, 1956)
Tāpat sadaloties māliem nātrijs ir kustīgāks nekā kālijs,
kaut gan kālijs vieglāk vieglāk piesaistās mālainiem minerāliem.
Tulkoja: normunds.grikitis@gmail.com
Autors: Игорь Жуков